Ayuno, limpieza celular y cáncer: ¿hay alguna conexión?

Nota: si eres un lector habitual, sabrás que me gusta etiquetar mis artículos del blog según los temas, p. ej. hay unas 40 publicaciones sobre ayuno, unas 30 sobre diabetes, y unas 50 sobre obesidad/calorías. Hago esto porque blogueo sobre lo que me interesa en ese momento y puede cambiar un poco. Esta nueva sección cubre la mTOR, la autofagia y la enfermedad mitocondrial, que como verás más adelante, están estrechamente relacionadas con los orígenes del cáncer.
A lo largo de la historia documentada de la humanidad, el ayuno ha sido un baluarte de las prácticas tradicionales de salud y curación. Esto es cierto en prácticamente todas las regiones y religiones del mundo. Las raíces de esta antigua tradición curativa pueden residir en el proceso de limpieza subcelular de la autofagia que la ciencia acaba de descifrar. La autofagia es una de las vías conservadas evolutivamente más conocidas, y se puede observar en casi todos los organismos multicelulares y muchos organismos unicelulares. La autofagia es la respuesta del cuerpo a la falta de comida (ayuno) que estimula una vía de degradación de los componentes subcelulares.
Al digerir sus propios componentes, la célula hace dos cosas: primero, se deshace de proteínas innecesarias que puedan estar dañadas o tener alguna otra disfunción. En segundo lugar, recicla esas “piezas de repuestos” de aminoácidos en nuevos componentes celulares. Una de las ideas erróneas del recambio proteico normal es que estas proteínas descompuestas simplemente se eliminan del cuerpo de alguna manera, incluso si está completamente desnutrido. Esto lleva a repetir histéricamente que ayunar quema músculo. DIOS MÍO. Si no comes 96 comidas al día, ¡te marchitarás y morirás! ¡Morirás! El cuerpo almacena la energía de los alimentos como grasa, pero en cuanto no comes, quemas los músculos. ¡Morirás!
En verdad, nuestros cuerpos no son ni de lejos tan estúpidos. Una vez que estas antiguas proteínas se degradan en componentes de aminoácidos, el cuerpo decide si se eliminan en los riñones como residuos o se retienen para producir nuevas proteínas. Las proteínas están compuestas de componentes básicos llamados aminoácidos. Es como un Lego. Puedes descomponer tu antiguo avión de Lego que tenía un aspecto extraño y construir uno más nuevo y mejor utilizando los mismos bloques de construcción. Esto también es así en el cuerpo. Podemos descomponer las viejas y repugnantes proteínas en los componentes aminoácidos y usarlos para reconstruir nuevas proteínas más funcionales.



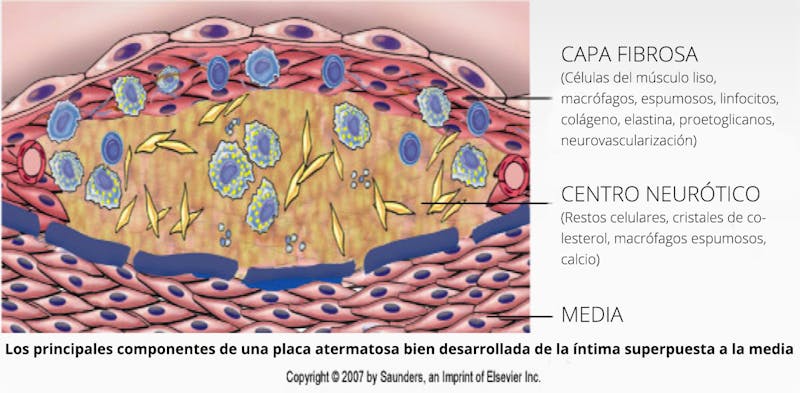
Por supuesto, si tu cuerpo tiene más proteína de la necesaria, entonces puede excretar el exceso de aminoácidos o convertirlo en energía. Si bien la mayoría de la gente piensa que crecer siempre es bueno, la verdad es que en los adultos el crecimiento casi siempre es malo. El cáncer es un crecimiento excesivo. La enfermedad de Alzheimer es la acumulación de demasiada proteína chatarra (ovillos neurofibrilares) en el cerebro. Los ataques al corazón y los accidentes cerebrovasculares son causados por placas ateromatosas, son una acumulación excesiva de muchas cosas, pero principalmente, de células musculares lisas, tejidos conjuntivos y sustancias degenerativas. Sí, un crecimiento excesivo del músculo liso es determinante para causar la aterosclerosis que provoca ataques cardíacos. Las enfermedades poliquísticas, como las de los riñones y los ovarios son excesos de crecimiento. La obesidad es un exceso de crecimiento.


¿Qué influye en la autofagia?
Ciertos tipos de estrés celular, incluyendo la privación de nutrientes, la agregación o el despliegue de proteínas (grupos de proteínas) o infecciones activan la autofagia para contrarrestar estos problemas y mantener la célula en buen estado de funcionamiento. Inicialmente, se pensó que este proceso no era selectivo, pero luego se demostró que era capaz de atacar selectivamente los organelos dañados (componentes subcelulares) y los patógenos invasores. El proceso fue descrito en mamíferos, pero también en insectos y hongos, donde gran parte del trabajo del Dr. Ohsumi se realizó desentrañando genes relacionados con la autofagia (ATG). Confirmó que esta vía de limpieza y reciclaje se conservó durante gran parte de la vida en la Tierra, desde en organismos unicelulares hasta en humanos.
La autofagia ocurre a un nivel basal en prácticamente todas las células, y es importante para el recambio de proteínas y orgánulos. Sin embargo, puede incrementarse para generar nutrientes y energía. Es decir, las proteínas se pueden quemar para obtener energía con el proceso de gluconeogénesis si es necesario. El estado de los nutrientes, las hormonas, la temperatura, el estrés oxidativo, la infección y el total de proteínas pueden afectar a la autofagia de diferentes formas.
El principal regulador de la autofagia es la quinasa de diana de rapamicina (TOR). También se conoce como TOR de mamíferos (mTOR) o TOR mecanicista. Cuando la mTOR sube, suprime la autofagia. La mTOR es muy sensible a los aminoácidos (proteínas) de la dieta.
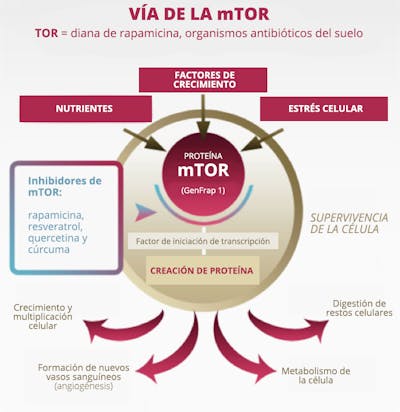


El otro principal regulador es la proteína quinasa activada por AMP 5 ‘(AMPK). Este es un sensor de energía intracelular, que se conoce como trifosfato de adenosina o ATP. Cuando la célula tiene mucha energía almacenada, tiene una gran cantidad de ATP, que es una especie de moneda de energía. Si tienes muchos dólares, eres rico. Si tienes mucho ATP, tu célula tiene mucha energía para hacer cosas.
La AMPK detecta la proporción de AMP/ATP y cuando esta relación es baja (bajos niveles de energía celular), la AMPK se activa. Baja energía celular = AMPK alta, por lo que es un tipo de indicador de combustible inverso según el estado de energía celular. Cuando la AMPK está alta (bajo nivel de combustible), esto detiene la síntesis de ácidos grasos y activa la autofagia. Esto tiene sentido. Si tus células no tienen energía, no querrán almacenar energía (crear grasa), sino que querrán activar la autofagia, eliminando el exceso de proteína y posiblemente quemándola para obtener energía.
Una vez que se activa la autofagia (disminución de la mTOR o aumento de la AMPK), se activan aproximadamente 20 genes (ATG) para llevar a cabo el proceso de limpieza. Estos codifican las proteínas que llevan a cabo el proceso real. Dado que la mTOR es una potente inhibidora de la autofagia (la mTOR actúa como un freno de la autofagia), bloquear la mTOR aumenta la autofagia (es decir, retira el pie de los frenos). Puedes hacerlo tomando el medicamento rapamicina, utilizado por primera vez como agente bloqueador inmunitario en los transplantes. Este medicamento fue descubierto en 1972, aislado de la bacteria Streptomyces Hygroscopicus de la Isla de Pascua, también conocida como Rapa Nui (de ahí el nombre de rapamicina). Fue desarrollado como un antihongos, pero finalmente se descubrió que tenía propiedades inmunosupresoras, por lo que se ganó su uso como medicamento antirechazo.
Casi todos los medicamentos antirechazo aumentan el riesgo de cáncer. El sistema inmune patrulla como guardias de seguridad, día tras día buscando células cancerosas errantes y matándolas. No las llaman células asesinas sin motivo, ¿no crees? Si eliminas a los guardias de seguridad con potentes medicamentos antirechazo, entonces el cáncer puede diseminarse sin parar. Y eso es exactamente lo que sucede con la mayoría de estos medicamentos.
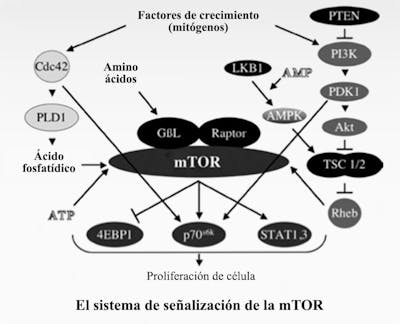


Pero no con la rapamicina. Curiosamente, este medicamento disminuyó el riesgo de cáncer. El mecanismo de acción, en el momento de su amplia implementación en la década de 1990, era en gran parte desconocido. Con el tiempo, utilizando modelos de hongos, se identificó el objetivo de la rapamicina (TOR) y pronto se descubrió la contraparte humana, de ahí el nombre TOR de los mamíferos, ahora con el apodo pegadizo: mTOR.
La mTOR se encuentra prácticamente en todos los organismos multicelulares y, de hecho, muchos organismos unicelulares como los hongos (donde se hace gran parte de la investigación sobre autofagia). Esta proteína es tan importante para la supervivencia que ningún organismo vivo funciona sin ella. El término técnico de esto es “conservado evolutivamente”. ¿Qué hace? En pocas palabras, es un sensor de nutrientes.
Una de las funciones más importantes para la sobrevivencia es vincular los nutrientes disponibles en el entorno y el crecimiento de la célula u organismo. Es decir, si no hay comida, las células deben dejar de crecer y entrar en un estado inactivo (como los hongos). Si los mamíferos sienten que no hay comida, también detienen el crecimiento excesivo de las células y comienzan a descomponer algunas proteínas. Si no lo hiciéramos, no sobreviviríamos.
La mTOR integra las señales entre los alimentos (disponibilidad de nutrientes) y el crecimiento celular. Si hay comida disponible, entonces crece. Si no hay comida disponible, deja de crecer. Esta es una tarea de vital importancia que subyace a todo el espectro de enfermedades de “demasiado crecimiento” de las que hablamos anteriormente. Es similar, pero mucho más antiguo que otro sensor de nutrientes del que hemos hablado mucho: la insulina.
Pero este conocimiento abre posibilidades terapéuticas completamente nuevas. Si tenemos muchas enfermedades de “crecimiento excesivo” (cáncer, aterosclerosis, obesidad, ovarios poliquísticos), entonces tenemos un nuevo objetivo. Si podemos cerrar los sensores de nutrientes, podemos detener gran parte de este crecimiento que nos enferma. Un nuevo comienzo.
¿Quieres leer más artículos del Dr. Fung? Aquí están sus publicaciones más populares sobre el cáncer:
Anteriormente
El cáncer como una enfermedad endocrina
El poder del tratamiento nutricional
Diabesidad: por qué los problemas de diabetes y obesidad tienen la misma raíz
Calorías parte 1: ¿Cómo ganamos peso?
El Dr. Fung tiene su propio blog en idmprogram.com. También publica frecuentemente en Twitter.
Su libro El Código de la Obesidad es disponible en Amazon.
Su libro nuevo, The Complete Guide to Fasting también está disponible en Amazon en inglés.